Los hidratos de carbono o carbohidratos o también llamados glúcidos, son uno de los 7 elementos nutritivos de la alimentación humana.
La combinación balanceada y variada de estos elementos son la mejor forma de mantenernos sanos y con mucha energía.
En el caso de los carbohidratos, resultan importantes para la producción de energía extra, el ahorro de proteínas y además regula el metabolismo de las grasas. Su bajo consumo tiene importantes repercusiones en el correcto funcionamiento de nuestro organismo, ya que el cerebro utiliza como principal fuente de energía la glucosa de los carbohidratos. Este excedente de glucosa es guardada en los músculos y el hígado convirtiéndose en una reserva de energía, por lo que si consumimos pocos carbohidratos nuestras reservas se agotaran rápidamente debido a nuestro constante ejercicio diario.
Por otro lado, si abusamos del consumo de alimentos ricos en carbohidratos, nuestras reservas se saturarán y la glucosa de los carbohidratos quedarán flotando en la sangre hasta convertirse en grasa, la que luego será guardada. Esto trae como consecuencia que engordemos rápidamente.
Los carbohidratos se clasifican en simples y complejos. Los primeros son conocidos también como monosacáridos y se caracterizan por su rápida absorción. Al ocurrir esto nuestro organismo secreta mayores cantidades de insulina, la responsable de estimular nuestro apetito y no dejar que las reservas de grasa sean quemadas. Los principales monosacáridos son la glucosa y la fructosa, y son precisamente estos dos los responsables del sabor dulce de algunas frutas.
Los carbohidratos complejos son llamados también polisacáridos y la energía que nuestro organismo consume proviene principalmente de allí debido a su lenta absorción. Algunos alimentos ricos en carbohidratos complejos son los panes, las pastas, los cereales, las legumbres, la avena, etc.
Una dieta baja en carbohidratos puede ayudar también a las mujeres a luchar contra el problema del cabello grasoso, ya que la glucosa encontrada en los azúcares contribuye a la mayor producción de testosterona y que en la mujer produce el cuero cabelludo graso, acné, agresividad, entre otros.
sábado, 17 de octubre de 2009
miércoles, 14 de octubre de 2009
lunes, 12 de octubre de 2009
PRUEBAS ICFES
Las estudiantes de grado once que la cantidad de preguntas del simulacro fue por debajo de 50, deben contestar las siguientes preguntas, y entregarlas en un trabajo escrito con las normas ICONTEC, para el día viernes 16 de octubre:
1. consulte 10 productos derivados del petróleo y la utilidad de estos en la vida del hombre.
2. explique 5 fuentes de energías alternativas que estén teniendo éxito en este momento y como se implementarían en la vida cotidiana.
3. seleccione un grupo funcional (de los vistos en clase), explique porque lo selecciono, y qué importancia tiene en tu vida.
4. Teniendo en cuanta que la energía solar es un tipo de energía ecológica, que acogida ha tenido en nuestro país y como se esta utilizando.
5. que programa implementarías en Colombia para que sus habitantes no usaran automóviles particulares, con el fin de reducir las emisiones de gases de efecto invernadero.
1. consulte 10 productos derivados del petróleo y la utilidad de estos en la vida del hombre.
2. explique 5 fuentes de energías alternativas que estén teniendo éxito en este momento y como se implementarían en la vida cotidiana.
3. seleccione un grupo funcional (de los vistos en clase), explique porque lo selecciono, y qué importancia tiene en tu vida.
4. Teniendo en cuanta que la energía solar es un tipo de energía ecológica, que acogida ha tenido en nuestro país y como se esta utilizando.
5. que programa implementarías en Colombia para que sus habitantes no usaran automóviles particulares, con el fin de reducir las emisiones de gases de efecto invernadero.
domingo, 20 de septiembre de 2009
METODOS DE SEPARACION DE MEZCLAS

GRADO DECIMO, Realizar en su cuaderno un mapa conceptual sobre los diferentes metodos de separacion de sustancias, y su respectivo dibujo.
1) Destilación: La destilación es el procedimiento más utilizado para la separación y purificación de líquidos, y es el que se utiliza siempre que se pretende separar un líquido de sus impurezas no volátiles.
La destilación, como proceso, consta de dos fases: en la primera, el líquido pasa a vapor y en la segunda el vapor se condensa, pasando de nuevo a líquido en un matraz distinto al de destilación.
2) Evaporación: Consiste en calentar la mezcla hasta el punto de ebullición de uno de los componentes, y dejarlo hervir hasta que se evapore totalmente. Este método se emplea si no tenemos interés en utilizar el componente evaporado. Los otros componentes quedan en el envase.
Un ejemplo de esto se encuentra en las Salinas. Allí se llenan enormes embalses con agua de mar, y los dejan por meses, hasta que se evapora el agua, quedando así un material sólido que contiene numerosas sales tales como cloruro de sólido, de potasio, etc…
3) Centrifugación: Es un procedimiento que se utiliza cuando se quiere acelerar la sedimentación. Se coloca la mezcla dentro de una centrifuga, la cual tiene un movimiento de rotación constante y rápido, lográndose que las partículas de mayor densidad, se vayan al fondo y las más livianas queden en la parte superior.
Un ejemplo lo observamos en las lavadoras automáticas o semiautomáticas. Hay una sección del ciclo que se refiere a secado en el cual el tambor de la lavadora gira a cierta velocidad, de manera que las partículas de agua adheridas a la ropa durante su lavado, salen expedidas por los orificios del tambor.
4) Levigación: Se utiliza una corriente de agua que arrastra los materiales más livianos a través de una mayor distancia, mientras que los más pesados se van depositando; de esta manera hay una separación de los componentes de acuerdo a lo pesado que sean.
5) Imantación: Se fundamenta en la propiedad de algunos materiales de ser atraídos por un imán. El campo magnético del imán genera una fuente atractora, que si es suficientemente grande, logra que los materiales se acercan a él. Para poder usar este método es necesario que uno de los componentes sea atraído y el resto no.
6) Cromatografía de Gases: La cromatografía es una técnica cuya base se encuentra en diferentes grados de absorción, que a nivel superficial, se pueden dar entre diferentes especies químicas. En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino.Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
7) Cromatografía en Papel: Se utiliza mucho en bioquímica, es un proceso donde el absorbente lo constituye un papel de Filtro. Una vez corrido el disolvente se retira el papel y se deja secar, se trata con un reactivo químico con el fin de poder revelar las manchas.
En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino.
Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
8) Decantación: Consiste en separar materiales de distinta densidad. Su fundamento es que el material más denso
En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino.
Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
9) Tamizado: Consiste en separar partículas sólidas de acuerdo a su tamaño. Prácticamente es utilizar coladores de diferentes tamaños en los orificios, colocados en forma consecutiva, en orden decreciente, de acuerdo al tamaño de los orificios. Es decir, los de orificios más grandes se encuentran en la parte superior y los más pequeños en la inferior. Los coladores reciben el nombre de tamiz y están elaborados en telas metálicas.
10) Filtración: Se fundamenta en que alguno de los componentes de la mezcla no es soluble en el otro, se encuentra uno sólido y otro líquido. Se hace pasar la mezcla a través de una placa porosa o un papel de filtro, el sólido se quedará en la superficie y el otro componente pasará.
Se pueden separar sólidos de partículas sumamente pequeñas, utilizando papeles con el tamaño de los poros adecuados.
1) Destilación: La destilación es el procedimiento más utilizado para la separación y purificación de líquidos, y es el que se utiliza siempre que se pretende separar un líquido de sus impurezas no volátiles.
La destilación, como proceso, consta de dos fases: en la primera, el líquido pasa a vapor y en la segunda el vapor se condensa, pasando de nuevo a líquido en un matraz distinto al de destilación.
2) Evaporación: Consiste en calentar la mezcla hasta el punto de ebullición de uno de los componentes, y dejarlo hervir hasta que se evapore totalmente. Este método se emplea si no tenemos interés en utilizar el componente evaporado. Los otros componentes quedan en el envase.
Un ejemplo de esto se encuentra en las Salinas. Allí se llenan enormes embalses con agua de mar, y los dejan por meses, hasta que se evapora el agua, quedando así un material sólido que contiene numerosas sales tales como cloruro de sólido, de potasio, etc…
3) Centrifugación: Es un procedimiento que se utiliza cuando se quiere acelerar la sedimentación. Se coloca la mezcla dentro de una centrifuga, la cual tiene un movimiento de rotación constante y rápido, lográndose que las partículas de mayor densidad, se vayan al fondo y las más livianas queden en la parte superior.
Un ejemplo lo observamos en las lavadoras automáticas o semiautomáticas. Hay una sección del ciclo que se refiere a secado en el cual el tambor de la lavadora gira a cierta velocidad, de manera que las partículas de agua adheridas a la ropa durante su lavado, salen expedidas por los orificios del tambor.
4) Levigación: Se utiliza una corriente de agua que arrastra los materiales más livianos a través de una mayor distancia, mientras que los más pesados se van depositando; de esta manera hay una separación de los componentes de acuerdo a lo pesado que sean.
5) Imantación: Se fundamenta en la propiedad de algunos materiales de ser atraídos por un imán. El campo magnético del imán genera una fuente atractora, que si es suficientemente grande, logra que los materiales se acercan a él. Para poder usar este método es necesario que uno de los componentes sea atraído y el resto no.
6) Cromatografía de Gases: La cromatografía es una técnica cuya base se encuentra en diferentes grados de absorción, que a nivel superficial, se pueden dar entre diferentes especies químicas. En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino.Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
7) Cromatografía en Papel: Se utiliza mucho en bioquímica, es un proceso donde el absorbente lo constituye un papel de Filtro. Una vez corrido el disolvente se retira el papel y se deja secar, se trata con un reactivo químico con el fin de poder revelar las manchas.
En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino.
Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
8) Decantación: Consiste en separar materiales de distinta densidad. Su fundamento es que el material más denso
En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino.
Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
9) Tamizado: Consiste en separar partículas sólidas de acuerdo a su tamaño. Prácticamente es utilizar coladores de diferentes tamaños en los orificios, colocados en forma consecutiva, en orden decreciente, de acuerdo al tamaño de los orificios. Es decir, los de orificios más grandes se encuentran en la parte superior y los más pequeños en la inferior. Los coladores reciben el nombre de tamiz y están elaborados en telas metálicas.
10) Filtración: Se fundamenta en que alguno de los componentes de la mezcla no es soluble en el otro, se encuentra uno sólido y otro líquido. Se hace pasar la mezcla a través de una placa porosa o un papel de filtro, el sólido se quedará en la superficie y el otro componente pasará.
Se pueden separar sólidos de partículas sumamente pequeñas, utilizando papeles con el tamaño de los poros adecuados.
QUE ES EL AMONIACO (SEPTIMA UNIDAD 11º)
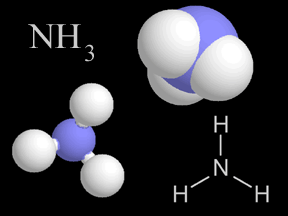
El amoníaco es una sustancia química producida tanto por los seres humanos como la naturaleza. Consiste de una parte de nitrógeno (N) y tres partes de hidrógeno (H3). La cantidad de amoníaco producida cada año por seres humanos es casi la misma producida anualmente por la naturaleza. Sin embargo, cuando se encuentra amoníaco en niveles que pueden causar preocupación, éstos probablemente se deben a su producción directa o indirecta por seres humanos.
El amoníaco es un gas incoloro de olor muy penetrante. Esta forma del amoníaco se conoce también como amoníaco gaseoso o amoníaco anhidro ("sin agua"). El amoníaco gaseoso puede ser comprimido y bajo presión puede transformarse en un líquido. La mayoría de la gente está familiarizada con el olor del amoníaco debido a su uso en sales aromáticas, detergentes de uso doméstico y productos para limpiar vidrios. El amoníaco se disuelve fácilmente en agua. Esta forma se conoce también como amoníaco líquido, amoníaco acuoso o solución de amoníaco. En agua, la mayor parte del amoníaco se transforma en la forma iónica del amoníaco, conocida como iones de amonio, representada por la fórmula NH4+ (un ión es un átomo o grupo de átomos que ha adquirido una carga eléctrica neta al ganar o perder uno o más electrones). Los iones de amonio no son gases ni tienen olor. En pozos, ríos, lagos y suelos húmedos, la forma iónica del amoníaco es la más común. El amoníaco también puede combinarse con otras sustancias para formar compuestos de amonio, como por ejemplo sales como el cloruro de amonio, sulfato de amonio, nitrato de amonio y otras sales.
El amoníaco es sumamente importante para las plantas, los animales y los seres humanos. Se encuentra en el agua, el suelo y el aire, y es una fuente de nitrógeno que necesitan las plantas y los animales. La mayor parte del amoníaco en el ambiente se deriva de la descomposición natural de estiércol y de plantas y animales muertos.
El 80% del amoníaco que se manufactura se usa como abono. Un tercio de esta cantidad se aplica directamente al suelo en forma de amoníaco puro. El resto se usa para producir otros abonos que contienen compuestos de amonio, generalmente sales de amonio. Estos abonos se usan para suministrar nitrógeno a las plantas. El amoníaco se usa también para fabricar fibras sintéticas, plásticos y explosivos. Numerosos productos de limpieza también contienen amoníaco en la forma de iones de amonio.
El amoníaco es un gas incoloro de olor muy penetrante. Esta forma del amoníaco se conoce también como amoníaco gaseoso o amoníaco anhidro ("sin agua"). El amoníaco gaseoso puede ser comprimido y bajo presión puede transformarse en un líquido. La mayoría de la gente está familiarizada con el olor del amoníaco debido a su uso en sales aromáticas, detergentes de uso doméstico y productos para limpiar vidrios. El amoníaco se disuelve fácilmente en agua. Esta forma se conoce también como amoníaco líquido, amoníaco acuoso o solución de amoníaco. En agua, la mayor parte del amoníaco se transforma en la forma iónica del amoníaco, conocida como iones de amonio, representada por la fórmula NH4+ (un ión es un átomo o grupo de átomos que ha adquirido una carga eléctrica neta al ganar o perder uno o más electrones). Los iones de amonio no son gases ni tienen olor. En pozos, ríos, lagos y suelos húmedos, la forma iónica del amoníaco es la más común. El amoníaco también puede combinarse con otras sustancias para formar compuestos de amonio, como por ejemplo sales como el cloruro de amonio, sulfato de amonio, nitrato de amonio y otras sales.
El amoníaco es sumamente importante para las plantas, los animales y los seres humanos. Se encuentra en el agua, el suelo y el aire, y es una fuente de nitrógeno que necesitan las plantas y los animales. La mayor parte del amoníaco en el ambiente se deriva de la descomposición natural de estiércol y de plantas y animales muertos.
El 80% del amoníaco que se manufactura se usa como abono. Un tercio de esta cantidad se aplica directamente al suelo en forma de amoníaco puro. El resto se usa para producir otros abonos que contienen compuestos de amonio, generalmente sales de amonio. Estos abonos se usan para suministrar nitrógeno a las plantas. El amoníaco se usa también para fabricar fibras sintéticas, plásticos y explosivos. Numerosos productos de limpieza también contienen amoníaco en la forma de iones de amonio.
miércoles, 8 de julio de 2009
ELECTROLISIS (GRADO 10A Y B)
 Electrolisis, parte de la química que trata de la relación entre las corrientes eléctricas y las reacciones químicas, y de la conversión de la energía química en eléctrica y viceversa. En un sentido más amplio, la electrolisis es el estudio de las reacciones químicas que producen efectos eléctricos y de los fenómenos químicos causados por la acción de las corrientes o voltajes.
Electrolisis, parte de la química que trata de la relación entre las corrientes eléctricas y las reacciones químicas, y de la conversión de la energía química en eléctrica y viceversa. En un sentido más amplio, la electrolisis es el estudio de las reacciones químicas que producen efectos eléctricos y de los fenómenos químicos causados por la acción de las corrientes o voltajes.La mayoría de los compuestos inorgánicos y algunos de los orgánicos se ionizan al fundirse o cuando se disuelven en agua u otros líquidos; es decir, sus moléculas se disocian en componentes cargados positiva y negativamente que tienen la propiedad de conducir la corriente eléctrica. Si se coloca un par de electrodos en una disolución de un electrolito (o compuesto ionizable) y se conecta una fuente de corriente continua entre ellos, los iones positivos de la disolución se mueven hacia el electrodo negativo y los iones negativos hacia el positivo. Al llegar a los electrodos, los iones pueden ganar o perder electrones y transformarse en átomos neutros o moléculas; la naturaleza de las reacciones del electrodo depende de la diferencia de potencial o voltaje aplicado.
La acción de una corriente sobre un electrolito puede entenderse con un ejemplo sencillo. Si el sulfato de cobre se disuelve en agua, se disocia en iones cobre positivos e iones sulfato negativos. Al aplicar una diferencia de potencial a los electrodos, los iones cobre se mueven hacia el electrodo negativo, se descargan, y se depositan en el electrodo como elemento cobre. Los iones sulfato, al descargarse en el electrodo positivo, son inestables y combinan con el agua de la disolución formando ácido sulfúrico y oxígeno. Esta descomposición producida por una corriente eléctrica se llama electrólisis.
En todos los casos, la cantidad de material que se deposita en cada electrodo al pasar la corriente por un electrolito sigue la ley descubierta por el químico físico británico Michael Faraday.
VER VIDEO: http://www.youtube.com/watch?v=UjPZKgxPxS0
domingo, 31 de mayo de 2009
EL PETROLEO

El petróleo es un líquido oleoso bituminoso (color oscuro) de origen natural compuesto por diferentes sustancias orgánicas (es una mezcla de hidrocarburos, aunque también suelen contener unos pocos compuestos de azufre y de oxígeno). Es, como el carbón, un combustible fósil. También recibe los nombres de petróleo crudo, crudo petrolífero o simplemente "crudo". Aunque se trata de un líquido aceitoso de color oscuro, es considerado una roca sedimentaria.
El petróleo se forma a partir de restos de pequeños organismos marinos que viven en cantidades enormes en mares cálidos y poco profundos. Si al morir estos organismos son rápidamente enterrados por sedimentos, fermentarán. Pasados millones de años, bajo la presión de nuevas capas de sedimentos, los restos orgánicos se transformarán en petróleo. El proceso comenzó hace muchos millones de años, cuando surgieron los organismos vivos en grandes cantidades, y continúa hasta el presente
Se encuentra en grandes cantidades bajo la superficie terrestre, en los estratos superiores de la corteza terrestre. Esto se debe a que el petróleo tiende a escapar a zonas más altas en las que soporte menos presión. En este viaje, Con frecuencia acaban encontrando un esquisto impermeable o una capa de roca densa y se acumula, ya que son determinadas zonas de las que no puede salir: son las trampas. En otras ocasiones consigue alcanzar la superficie. Cuando ocurre esto el petróleo se volatiza dejando un residuo de asfalto y betún. No es de extrañar, por tanto, que fuese conocido ya por las antiguas civilizaciones. Los egipcios utilizaban el betún para impermeabilizar los barcos y para embalsamar las momias. Sin embargo, tan sólo desde finales del siglo XIX viene utilizándose a gran escala como combustible.
Composición Química del petróleo
En una mezcla muy compleja de composición variable, de hidrocarburos de muchos puntos de ebullición y estados sólido, líquido y gaseoso, que se disuelven unos en otros para formar una solución de viscosidad variable.
Contiene:
Hidrocarburos saturados o parafinas. Formula general
Hidrocarburos etilénicos u oleifinas.
Hidrocarburos acetilénicos.
Hidrocarburos cíclicos ciclánicos.
Hidrocarburos bencénicos o aromáticos.
Compuestos oxigenados (derivados de hidrocarburos etilénicos, por oxidación y polimerización)
Compuestos sulfurados (tiofeno, etc.)
Compuestos nitrogenados cíclicos (piridina, etc)
En el petróleo natural, además de hidrocarburos, existen nitrógeno, azufre, oxígeno, colesterina, productos derivados de la clorofila y de las heminas (porfirinas) y, como elementos, trazas, vanadio, níquel, cobalto y molibdeno.
Como consecuencia de los compuestos orgánicos nombrados, el petróleo presenta polarización rotatoria, lo cual revela claramente que se trata de un compuesto de origen orgánico, formado a partir de restos animales y vegetales.
La composición química del petróleo es muy variable, hasta el punto de que los cuatro tipos fundamentales de hidrocarburos: parafinas (hidrocarburos saturados), olefinas (hidrocarburos insaturados), naftenos (hidrocarburos cíclicos saturados o cicloalcanos,), e hidrocarburos aromáticos, no solamente son diferentes de un yacimiento a otro, sino también las diversas sustancias que es preciso eliminar más o menos completamente: gas, azufre (que junto con el sulfhídrico, mercaptanos y tioalcoholes pueden alcanzar un 3%), agua más o menos salada, compuestos oxigenados y nitrogenados, indicios o vestigios de metales etc.
Un análisis en el laboratorio proporciona primeramente indicaciones sobre la cantidad y calidad de los productos acabados que se pueden extraer del petróleo crudo:
alta tensión de vapor, revela la presencia de gas.
alta densidad y viscosidad, indican una reducida proporción de gasolina o un contenido importante de betún o parafina.
Clasificación del petróleo
La clasificación se basa en la clase de hidrocarburos que predominan en el petróleo crudo:
Petróleo de base parafínicas
Predominan los hidrocarburos saturados o parafínicos.
Son muy fluidos de colores claros y bajo peso específico (aproximadamente 0,85 kg./lt).
Por destilación producen abundante parafina y poco asfalto.
Son los que proporcionan mayores porcentajes de nafta y aceite lubricante.
Petróleo de base asfáltica o nafténica
Predominan los hidrocarburos etilénicos y diétilinicos, cíclicos ciclánicos (llamados nafténicos), y bencenicos o aromáticos.
Son muy viscosos, de coloración oscura y mayor peso específico (aproximadamente 0,950 kg/lt)
Por destilación producen un abundante residuo de asfalto. Las asfaltitas o rafealitas argentinos fueron originadas por yacimientos de este tipo, que al aflorar perdieron sus hidrocarburos volátiles y sufrieron la oxidación y polimerización de los etílenicos.
Petróleo de base mixta
De composición de bases intermedias, formados por toda clase de hidrocarburos: Saturados, no saturados (etilénicos y acetilénicos) y cíclicos (ciclánicos o nafténicos y bencénicos o aromáticos).
La mayoría de los yacimientos mundiales son de esto tipo.
A su vez la composición de los hidrocarburos que integran el petróleo varía según su lugar de origen:
petróleos americanos: hidrocarburos de cadena abierta o alifáticos.
petróleos de Pensilvania: hidrocarburos saturados (alcanos de nº de C = 1 a 40)
petróleos de Canadá: hidrocarburos no saturados.
petróleos rusos: hidrocarburos cíclicos, con 3, 4, 5, ó 6 átomos de carbono en cadena abierta o cerrada.
VER VIDEO: http://www.youtube.com/watch?v=y2TQ6Grxe4Q
miércoles, 6 de mayo de 2009
RECICLAJE DE PLASTICO




La segunda campaña de reciclaje se realizo el jueves 31 de mayo, el material que se reciclo fue el plàstico, los cursos ganadores fueron 10A, 9A y 9B, en promaria 4B, eta semana iniciamos la campña con el reciclaje de revistas. Extendemos la invitacion a los grados onces, 6A,6B, y 8B, pues esta semana no contamos con su colaboracion.
CAMPAÑA DE RECICLAJE DE PAPEL
Como una de las actividades del concurso de orden y aseo en los salones, organizado por el area de Ciencias Naturales, estan las campañas de reciclaje, la primera que se llevo a cabo fue la de papel teniendo una gran participacion de todos los cursos, los cursos ganadores fueron 9A,9B y 8B, a estos cursos les deseamos mucha suerte en el concurso y empezaron muy bien. invitamos a todas las estudiantes del colegio de la presentacion a que participen en las proximas campañas. El grado 10B por obtener la menor calificacion de la semana le correspondio hacer la campaña de separacion de residuos a la hora del descanso, las estudiantes se organizaron e hicieron un buen trabajo. felicitaciones a las estudiantes de este grado, ojala y nunca mas vuelvan a quedar de ultimas.
lunes, 20 de abril de 2009
DIA INTERNACIONAL DE LA TIERRA

El Día de la Tierra se creó bajo la plena convicción de que las personas, trabajando juntas, pueden lograr cosas extraordinarias. Basándose en esta afirmación, el 22 de abril de cada año se celebra una de las más grandes manifestaciones a nivel mundial. Miles de millones de personas de todo el mundo unen sus voces al acorde por un ambiente global sostenible.
Aunque en Colombia existe un poco de conciencia ambiental y de participación ciudadana en este tipo de celebraciones queremos que cada día sea mayor. Por eso El área de Ciencias del COLEGIO DE LA PRESENTACION quiere inspirarte para que comiences a preocuparte por el planeta.
Realiza un listado de 5 acciones que te comprometes en este día a cumplir, en pro de la conservación del medio ambiente.
Recuerda “La tierra que habitamos no la heredamos de nuestros padres, la tomamos prestada de nuestros hijos”
¿QUIENES SE COMPROMETEN A CUIDAR EL PLANETA, A PONER UN GRANITO DE ARENA PARA EVITAR SU DESTRUCCION? TU TE COMPROMETES?
Aunque en Colombia existe un poco de conciencia ambiental y de participación ciudadana en este tipo de celebraciones queremos que cada día sea mayor. Por eso El área de Ciencias del COLEGIO DE LA PRESENTACION quiere inspirarte para que comiences a preocuparte por el planeta.
Realiza un listado de 5 acciones que te comprometes en este día a cumplir, en pro de la conservación del medio ambiente.
Recuerda “La tierra que habitamos no la heredamos de nuestros padres, la tomamos prestada de nuestros hijos”
¿QUIENES SE COMPROMETEN A CUIDAR EL PLANETA, A PONER UN GRANITO DE ARENA PARA EVITAR SU DESTRUCCION? TU TE COMPROMETES?
lunes, 13 de abril de 2009
EL CARBONO. (11º)

El principal uso industrial del carbono es como componente de hidrocarburos, especialmente los combustibles fósiles (petróleo y gas natural). Del primero se obtienen, por destilación en las refinerías, gasolinas, keroseno y aceites, siendo además la materia prima empleada en la obtención de plásticos. El segundo se está imponiendo como fuente de energía por su combustión más limpia. Otros usos son:
El isótopo carbono-14, descubierto el 27 de febrero de 1940, se usa en la datación radiométrica.
El grafito se combina con arcilla para fabricar las minas de los lápices. Además se utiliza como aditivo en lubricantes. Las pinturas anti-radar utilizadas en el camuflaje de vehículos y aviones militares están basadas igualmente en el grafito, intercalando otros compuestos químicos entre sus capas. Es negro y blando. Sus átomos están distribuidos en capas paralelas muy separadas entre sí. Se forma a menos presión que el diamante. Aunque parezca difícil de creer, un diamante y la mina de un lapicero tienen la misma composición química: carbono.
El diamante Es transparente y muy duro. En su formación, cada átomo de carbono está unido de forma compacta a otros cuatro átomos. Se originan con temperaturas y presiones altas en el interior de la tierra. Se emplea para la construcción de joyas y como material de corte aprovechando su dureza.
Como elemento de aleación principal de los aceros.
En varillas de protección de reactores nucleares.
Las pastillas de carbón se emplean en medicina para absorber las toxinas del sistema digestivo y como remedio de la flatulencia.
El carbón activado se emplea en sistemas de filtrado y purificación de agua.
El carbón amorfo ("hollín") se añade a la goma para mejorar sus propiedades mecánicas. Además se emplea en la formación de electrodos (p. ej. de las baterías). Obtenido por sublimación del grafito, es fuente de los fulerenos que pueden ser extraídos con disolventes orgánicos.
Las fibras de carbón (obtenido generalmente por termólisis de fibras de poliacrilato) se añaden a resinas de poliéster, donde mejoran mucho la resistencia mecánica sin aumentar el peso, obteniéndose los materiales denominados fibras de carbono.
Las propiedades químicas y estructurales de los fulerenos, en la forma de nanotubos, prometen usos futuros en el incipiente campo de la nanotecnología.
Ver http://www.youtube.com/watch?v=7yX0GCr8nVc
El isótopo carbono-14, descubierto el 27 de febrero de 1940, se usa en la datación radiométrica.
El grafito se combina con arcilla para fabricar las minas de los lápices. Además se utiliza como aditivo en lubricantes. Las pinturas anti-radar utilizadas en el camuflaje de vehículos y aviones militares están basadas igualmente en el grafito, intercalando otros compuestos químicos entre sus capas. Es negro y blando. Sus átomos están distribuidos en capas paralelas muy separadas entre sí. Se forma a menos presión que el diamante. Aunque parezca difícil de creer, un diamante y la mina de un lapicero tienen la misma composición química: carbono.
El diamante Es transparente y muy duro. En su formación, cada átomo de carbono está unido de forma compacta a otros cuatro átomos. Se originan con temperaturas y presiones altas en el interior de la tierra. Se emplea para la construcción de joyas y como material de corte aprovechando su dureza.
Como elemento de aleación principal de los aceros.
En varillas de protección de reactores nucleares.
Las pastillas de carbón se emplean en medicina para absorber las toxinas del sistema digestivo y como remedio de la flatulencia.
El carbón activado se emplea en sistemas de filtrado y purificación de agua.
El carbón amorfo ("hollín") se añade a la goma para mejorar sus propiedades mecánicas. Además se emplea en la formación de electrodos (p. ej. de las baterías). Obtenido por sublimación del grafito, es fuente de los fulerenos que pueden ser extraídos con disolventes orgánicos.
Las fibras de carbón (obtenido generalmente por termólisis de fibras de poliacrilato) se añaden a resinas de poliéster, donde mejoran mucho la resistencia mecánica sin aumentar el peso, obteniéndose los materiales denominados fibras de carbono.
Las propiedades químicas y estructurales de los fulerenos, en la forma de nanotubos, prometen usos futuros en el incipiente campo de la nanotecnología.
Ver http://www.youtube.com/watch?v=7yX0GCr8nVc
ENLACE QUIMICO
1. Introducción
Cuándo hacemos leche en polvo, o cuando le echamos azúcar al té, ¿desaparece la leche o el azúcar? Claro que no, uno respondería que estos se están disolviendo en el agua. Pero en realidad, ¿Qué sucede? ¿Por qué sucede? Son hechos tan comunes que se nos olvida hacernos estas preguntas. En realidad lo que sucede es que la leche y el azúcar son solutos, que serán disueltos en un solvente como el agua. Pero ¿qué es lo que en realidad sucede? ¿Qué son los solutos y los solventes? Bueno estas preguntas serán respondidas en este informe.
Este informe habla de enlaces y soluciones, pero, para entenderlos hay que empezar por conocer el significado de estas palabras, para luego poder pasar a un lenguaje más técnico. Enlace significa unión, un enlace químico es la unión de dos o más átomos que se han unido con un solo fin, alcanzar la estabilidad, tratar de parecerse al gas noble más cercano, para la mayoría de los elementos alcanzar ocho electrones en su último nivel. Las soluciones son mezclas homogéneas, no se distinguen sus componentes como separados, entre al menos dos reactantes un soluto, que es él que será disuelto, y un solvente, que es él que disolverá al soluto.
¿Qué mantiene unidos a los Átomos?Un concepto básico en química es el estudio de cómo los átomos forman compuestos. La mayoría de los elementos que conocemos existen en la naturaleza formando agrupaciones de átomos iguales o de distintos tipos, enlazados entre sí.Todos los compuestos están constituidos por dos o más átomos de un o más elementos diferentes, unidos entre sí por enlaces ya sean estos iónicos o covalentes.
ver http://www.youtube.com/watch?v=IoV_n_kWbQ8&feature=PlayList&p=AF86E3DA70D47837&index=0&playnext=1
Cuándo hacemos leche en polvo, o cuando le echamos azúcar al té, ¿desaparece la leche o el azúcar? Claro que no, uno respondería que estos se están disolviendo en el agua. Pero en realidad, ¿Qué sucede? ¿Por qué sucede? Son hechos tan comunes que se nos olvida hacernos estas preguntas. En realidad lo que sucede es que la leche y el azúcar son solutos, que serán disueltos en un solvente como el agua. Pero ¿qué es lo que en realidad sucede? ¿Qué son los solutos y los solventes? Bueno estas preguntas serán respondidas en este informe.
Este informe habla de enlaces y soluciones, pero, para entenderlos hay que empezar por conocer el significado de estas palabras, para luego poder pasar a un lenguaje más técnico. Enlace significa unión, un enlace químico es la unión de dos o más átomos que se han unido con un solo fin, alcanzar la estabilidad, tratar de parecerse al gas noble más cercano, para la mayoría de los elementos alcanzar ocho electrones en su último nivel. Las soluciones son mezclas homogéneas, no se distinguen sus componentes como separados, entre al menos dos reactantes un soluto, que es él que será disuelto, y un solvente, que es él que disolverá al soluto.
¿Qué mantiene unidos a los Átomos?Un concepto básico en química es el estudio de cómo los átomos forman compuestos. La mayoría de los elementos que conocemos existen en la naturaleza formando agrupaciones de átomos iguales o de distintos tipos, enlazados entre sí.Todos los compuestos están constituidos por dos o más átomos de un o más elementos diferentes, unidos entre sí por enlaces ya sean estos iónicos o covalentes.
ver http://www.youtube.com/watch?v=IoV_n_kWbQ8&feature=PlayList&p=AF86E3DA70D47837&index=0&playnext=1
miércoles, 11 de marzo de 2009
BIENVENIDA
Hola bienvenidos a la pagina de química experimental, en ella encontraran artículos interesantes sobre productos químicos que usamos en la vida cotidiana. También encontraras como beneficia o perjudican nuestra salud estos productos químicos ya que la química es parte fundamental de nuestra vida.
ASIGNATURAS QUE ORIENTO
Oriento la asignatura de química, en los grados sextos, séptimo, octavo, noveno, décimo y once. La signatura es teorico-practica, en la institución contamos con un laboratorio muy completo para poner en practica lo visto.
martes, 10 de marzo de 2009
perfil

Mi nombre es Martha sofia Vargas Santana, tengo 28 años, Naci en la ciudad de Arauca. Estudie licenciatura en Biologia y Quimica,y en el año de 2003 me gradue de Especialista en Ingenieria Ambiental, en la actualidad me encuentro en la elaboracion de la tesis de mi segundo posgrado, especialista en Gerencia de la salud ocuapcional..
martes, 24 de febrero de 2009
LOS TINTES PARA EL CABELLO PODRIAN CAUSAR INFERTILIDAD

Las mujeres estilistas tienen un mayor riesgo de sufrir diferentes patologías relacionadas con su salud reproductiva, entre ellas tener hijos con malformaciones congénitas, infertilidad o trastornos menstruales, según un estudio hecho público por el Ministerio de Trabajo (España) .
El estudio relaciona este tipo de trastornos con las exposiciones que sufre este colectivo a productos químicos, como los tintes. Entre los productos químicos utilizados en las estéticas se han encontrado 12 tóxicos para la reproducción, sustancias cancerígenas, alteradores hormonales y otras alérgenas e irritantes. Además, el estudio advierte en sus conclusiones que las peluqueras utilizan muchos productos con distintos agentes químicos diferentes para una misma finalidad, lo que dificulta determinar los valores límites para la seguridad de estas trabajadoras. A esta circunstancia añade que ningún establecimiento de los visitados disponía de ventilación mecánica
El Instituto de la Mujer avisa que los químicos no son los únicos factores que influyen de manera negativa sobre las profesionales de la peluquería. Así, sus condiciones laborales, "como soportar una carga de trabajo elevada, jornadas superiores a las ocho horas y permanecer más de cuatro horas de pie", también han sido relacionadas con sus problemas reproductivos.
Suscribirse a:
Entradas (Atom)






